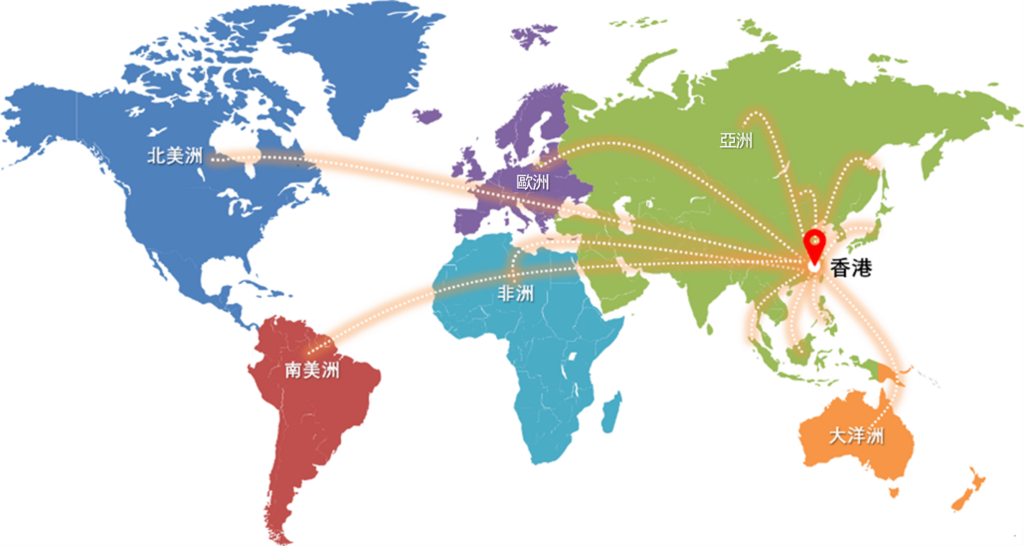
衞生署於六月宣布,將於2026年年底正式成立香港藥物及醫療器械監督管理中心(藥械監管中心),並從同年起逐步實施新藥「第一層審批」機制,標誌著香港在全球醫療創新領域邁出了重要一步,旨在打造國際醫療創新樞紐。憑藉香港的三大優勢,藥械監管中心有望吸引更多創新藥物及醫療器械(藥械)在港註冊和應用。
首先,香港作為一個人才薈萃的國際化城市,擁有五所全球排名前百的大學,其中兩間大學的醫學院位居全球前三十,匯聚大量醫療科技人才,亦積極籌備第三所醫學院。此外,香港是亞洲排名第一、全球排名第二的生物科技上市集資中心,擁有完善的法律制度和廉潔高效的政府,提供穩健且具透明度的營商環境。作為一個高度開放和自由的經濟體,香港吸引了多間跨國藥企進駐,亦為中小企業打造了一個極具競爭力的平台,協助它們累積國際化經驗和開拓全球市場。香港同時擁有一個富活力的創科生態圈,例如科學園( www.hkstp.org )有300多間生命健康科技相關初創及企業, InnoHK 的Health@InnoHK創新平台( www.innohk.gov.hk/zh-hk/r-d-centres/health-innohk )匯聚本地和海外頂尖大學的研究團隊,而位於河套區的深港科技創新合作區則促進香港與內地的跨境科研與產業協同發展。這個多元的創科生態系統,結合土地和政策扶持、優質研究、人才儲備,背靠粵港澳大灣區的8,700萬人口和生產腹地,為藥物及醫療器械企業落戶香港提供了堅實的支持。
其次,香港在「一國兩制」的政策下擔當國家超級連繫人的角色,其兩文三語、涵蓋中西藥的藥械監管制度,有效連接中西,成為國家和國際市場之間的橋樑。自2021年起實施的「港澳藥械通」計劃,讓本港使用的藥械經審批後用於粵港澳大灣區的指定醫療機構,至今已有115種醫療產品(51種藥品和64種醫療器械)獲准在45家指定的內地醫療機構使用,這大灣區市場對海外藥械企業具有巨大吸引力。另外,2023年實施了「1+」機制,允許新藥在符合要求的前提下,只需提交一個參考國家的藥物監管機構的許可,即可在香港申請註冊,比以往需要兩個藥物監管機構許可的要求加快受理。過去兩年,新的「1+」註冊機制成功縮短了多款創新藥品進入本地市場的時間。當2026年香港逐步分階段實施「第一層審批」後,將為內地創新藥走向國際市場,或全球藥械企業拓展內地以至亞洲市場提供另一具代表性的參考基準,進一步鞏固本港在醫療方面的戰略地位。我們期望通過國家藥品監督管理局和香港藥械監管中心的雙重註冊,令藥械更容易符合海外市場的監管要求,既彰顯中國創新藥在全球的競爭力,亦加強香港作為國際業務跳板的角色。
最後,香港擁有健全高效的藥械監管制度,不斷追求卓越。自2016年成為藥品檢查合作計劃(The Pharmaceutical Inspection Co-operation Scheme 或 PIC/S)成員,香港製造和註冊的藥品標準大幅提升,獲得了國際社會的高度認可。展望未來,藥械監管中心將繼續完善監管制度,包括盡快加入國際人用藥品註冊技術協調會(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use )成為監管成員,訂立醫療器械法規,並落實新藥「第一層審批」機制等;同時會利用新成立的「醫學實證與臨床卓越研究所」整合香港公私營醫療的數據和案例,探討篩查、診斷、治療和管理不同疾病的臨床做法,並評估各種醫療選項(如藥物、醫療器械、創新醫療科技)的效益,亦會善用設於河套的深港科技創新合作區香港園區的「粵港澳大灣區國際臨床試驗所」,與深圳園區的「粵港澳大灣區國際臨床試驗中心」共同構建一站式臨床試驗協作平台,加快評估創新藥械產品的效用。
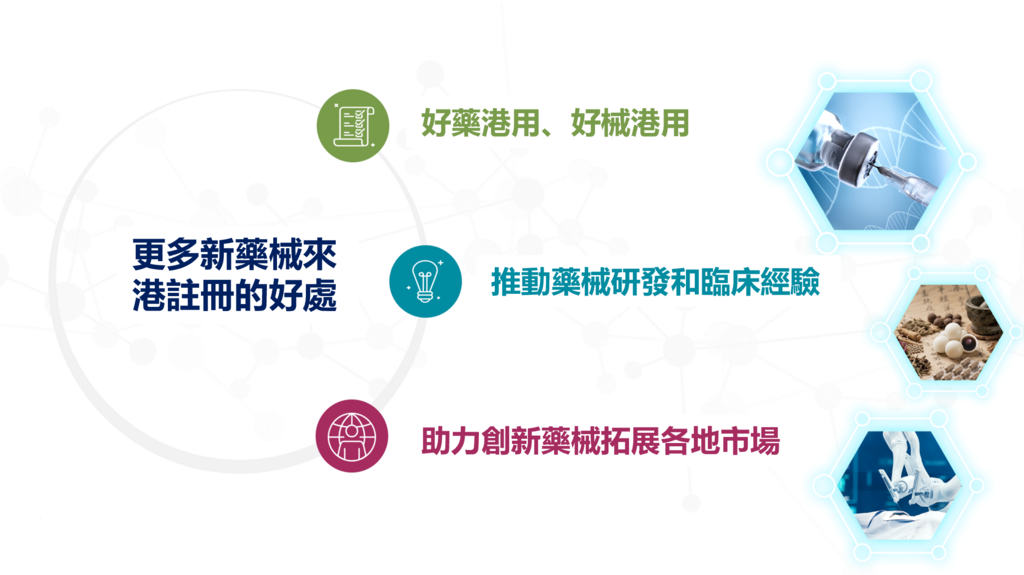
隨着監管制度日臻完善,香港在國際藥械監管體系中的地位將更加鞏固,不僅加快創新藥物的審批和臨床應用,亦大力推動本地及區域醫療產品研發和臨床試驗相關產業的蓬勃發展,助力香港成為全球醫療創新的重要樞紐。








 今日熱搜
今日熱搜

 本周熱搜
本周熱搜

 本月熱搜
本月熱搜





 查看更多
查看更多











