| 審批機制 | 特點 | |
| 「第一層審批」 | 無需任何海外藥物監管機構的註冊許可 | |
| 「第二層審批」 | 一般情況 | 來自兩個參考地區藥物監管機構的註冊許可 |
| 「1+」(新機制) | 來自一個參考地區藥物監管機構的註冊許可 | |
| 公共衛生緊急事態等(特殊情況) | 來自任何地區藥物監管機構的註冊許可 | |
衞生署自6月26日公布將由2026年起分階段推行「第一層審批」新藥註冊審批機制(本文只聚焦西藥,中成藥和醫療器械目前已有機制進行「第一層審批」),已在不同場合向持份者詳細介紹有關措施,包括與中國醫藥創新促進會及部分內地創新藥藥企代表會面。香港現行的新藥註冊審批制度是怎樣呢?此文將作簡要概述。
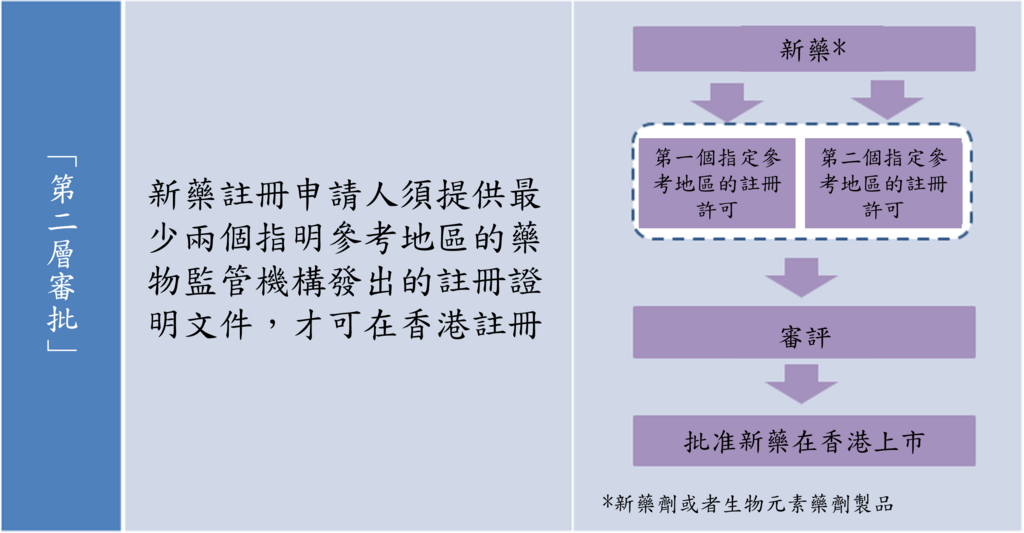
香港一直實行的是俗稱「第二層審批」的新藥註冊審批機制,這是一種依賴指明參考國家/地區的藥物監管機構審批結果的機制,現時香港共有36個參考地區,包括澳洲、巴西、加拿大、中國內地、歐盟26個國家、日本、韓國、新加坡、瑞士、英國及美國,「第二層審批」的核心原則是參考有關註冊許可作為香港註冊新藥的主要考慮,以減省重複的審評及資源上的負擔,這模式是世界衞生組織對資源不足的藥物監管機構的建議。在一般情況下,新藥須先獲得至少兩個指明參考地區藥物監管當局的註冊許可,隨後再由香港藥劑業及毒藥管理局進行審評,在確保藥物符合安全、效能和素質的要求下,才可在香港註冊。由於註冊申請人需要等待香港以外地區的註冊許可,整個流程通常較為耗時,從臨床結果公布至在香港獲批上市,可能需要約兩年的時間,這某程度上限制了新藥快速引入香港,雖然在處理公共衞生緊急事態的新藥註冊申請上,本港跟其他地區一樣,有特別機制處理一些個別特殊情況。
2023年11月1日起正式實施的「1+」新藥註冊機制是一項重要的創新措施,大大優化了香港的藥物註冊審批流程。「1+」機制是「第二層審批」的優化版,允許新藥在獲得一個指明參考地區(包括中國內地)藥物監管機構發出的註冊許可後,加上本地臨床數據及專家報告,即可在香港提交註冊申請,無需等待第二個參考地區的註冊許可,從而大大縮短了新藥在香港的註冊時間。這一機制令新藥,尤其那些在臨床上有迫切需求的藥品,能夠更快進入香港市場,滿足病人急切的醫療需求。「1+」機制大大加快了審批速度,是香港邁向「第一層審批」的重要里程碑,讓香港得以逐步積累寶貴經驗,從而奠定建立自主審批能力的基礎。

所謂「第一層審批」,即不需依賴任何海外藥監機構的註冊許可,透過自主審評涵蓋整個藥物產品生命週期(包括臨床前研究、臨床研究、藥械警戒研究,以及有關生產和品質控制等)的所有原始數據和資料,直接在本港審批藥物的機制。隨著「第一層審批」於2026年至2030年起分階段落實,香港可加快審批新藥上市,既推動創新藥的本地應用,亦促進內地的創新藥邁向國際。









 今日熱搜
今日熱搜

 本週熱搜
本週熱搜

 本月熱搜
本月熱搜





 查看更多
查看更多















